AIMS|中国 服务热线:021-51914748 或联系 在线客服
硫化氢(H2S)是一种无色、易燃、水溶性气体,具有臭鸡蛋的特征气味。H2S以前被认为是有毒气体和环境危害。然而,最近的科学研究表明,H2S 在哺乳动物组织中合成,并自由穿过细胞膜。H2S独立于任何特定的转运蛋白起作用,并且它对各种系统具有许多生物学效应。H2S被认为是第三种内源性气体递质,其次是NO和CO。H2S 广泛存在于哺乳动物中,在中枢和周围神经系统、心血管、免疫、内分泌、生殖和消化系统中充当信号分子,介导舒张压和血管生成、细胞死亡、炎症以及抗癌或致癌作用。
H2S通过半胱氨酸生物合成途径由哺乳动物物种中的三种重要酶产生;它们是胱硫氨酸γ-裂解酶(CSE)、胱硫氨酸β-合酶(CBS)和3-巯基丙酮酸硫转移酶(MPST)。CBS和CSE主要位于细胞质中,而3-MST主要存在于线粒体和细胞质中。在缺氧条件下,CBS的C末端的线粒体靶向序列可以被 Hsp70 识别并转运到线粒体,而 CSE 进入由外膜转位酶介导的线粒体腔,CBS和CSE的最佳pH值为8.5–9.0,3-MST的最佳pH值为7.4,而胞质溶胶的pH值为7–7.4,线粒体腔的pH值为8.0,为弱碱性。在缺氧条件下,CBS和CSE被转运到线粒体腔,这种pH条件下有利于产生H2S,这可能是细胞在缺氧下的一种自动调节机制。这三种酶催化的底物是 l-半胱氨酸、l-同型半胱氨酸和 3-巯基丙酮酸,然后是少量的 l-胱氨酸和 d-半胱氨酸。
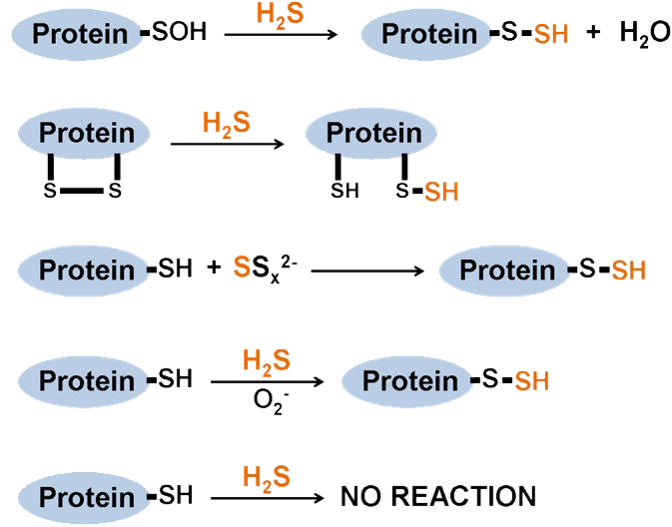
S-过硫化是H对靶蛋白的特定半胱氨酸残基的化学修饰,在H2S存在的情况下, 半胱氨酸残基的游离硫醇基团,共价转化为过硫化物基团。S-过硫化可通过H2S诱导,在半胱氨酸亚磺酸(Cys-SOH)或半胱氨酸二硫化物(─S─S)上的S位点发生修饰(如图),或通过半胱氨酸硫醇上的多硫化物。与S-亚硝化类似,蛋白质S-硫化被硫氧还蛋白系统逆转。 。
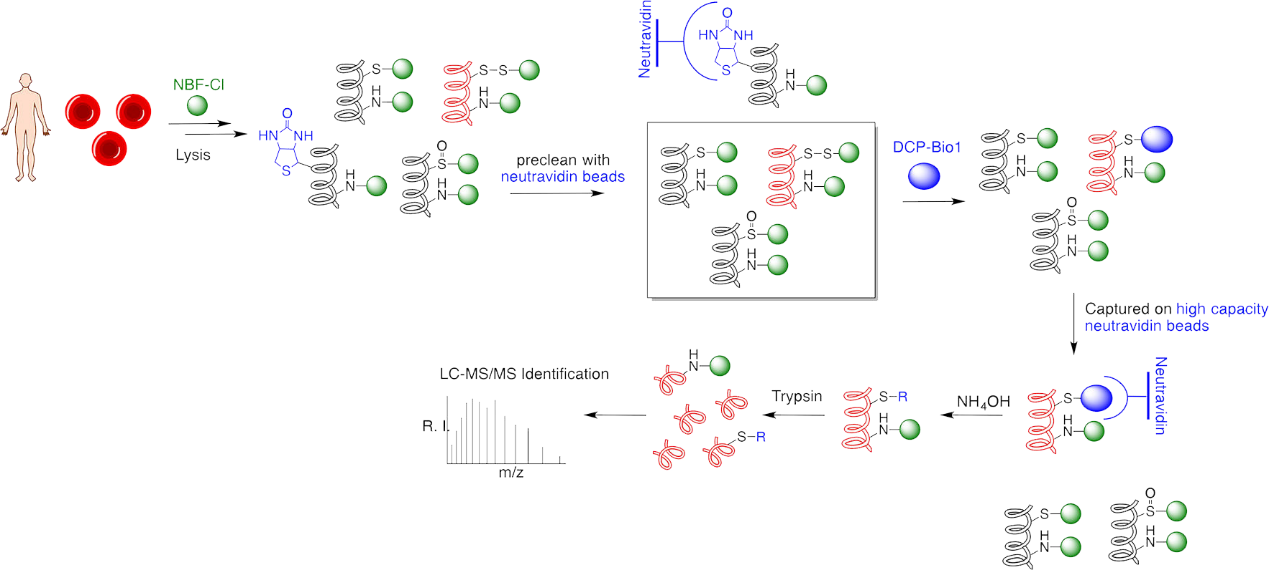
有几种检测 S-硫水合的方法,例如改良的生物素开关测定法、带有荧光硫醇修饰剂的马来酰亚胺测定法、标签开关法和质谱法:
S-过硫化修饰的检测(Detection of S‐sulfhydration)
由于过硫化物基团与硫醇基团的反应性相似,因此很难将它们区分开来。以前用于S-亚硝基化测量的生物素开关已被修改为检测 S-硫化,这被称为“改良的生物素开关测定法”。烷化剂S-甲基甲硫代磺酸酯(MMTS)用于阻断蛋白质中的硫醇。过硫化物基团与Bio-HPDP进行偶联。然后对生物素化的蛋白质进行免疫沉淀并通过蛋白质印迹法进行分析,蛋白质印迹代表蛋白质S-硫化水平。然而,硫醇和过硫化物表现出与MMTS相似的反应性,选择性较差。基础S-硫化蛋白占25%,其中大部分可能是假阳性。
S-过硫化修饰也能够用马来酰亚胺测定法和荧光硫醇修饰剂来测量。荧光马来酰亚胺作用于修饰和未修饰的巯基。DTT仅减少修饰的半胱氨酸,并且通过SDS-PAGE检测代表S-硫水合合的降低的荧光强度。不幸的是,用马来酰胺测定法测定S-亚硝基化和S-亚磺酸的倾向削弱了其检测S-硫水合物的可信度。
另外有一种新的S-硫化选择性测量方法,称为“标签开关法”。甲基磺酰苯并噻唑(MSBT)用于封闭硫醇。然后,含有亲核试剂和生物素的试剂仅标记过硫化物,而与封闭的硫醇基团没有结合。最后,将MSBT标记的代表S-硫化物的过硫化物与链霉亲和素偶联,并通过蛋白质印迹可视化。然而,没有更高灵敏度的方法给S-硫水合测量带来了问题。为了提高灵敏度,后续又有科学方法提出了一种改进的标签开关方法,使用新的氰乙酸衍生物,如荧光BODIPY部分或Cy3染料可以进行蛋白凝胶检测分析。
质谱(MS)分析也用于过滤和鉴定蛋白质S-过硫化修饰。用MSBT封闭蛋白质样品后,只有过硫化物加合物与CN-生物素反应形成生物素标记的加合物。然后,这些生物素标记的蛋白质被分解成MS的肽。通过将研究结果与蛋白质数据库进行比较,确定了S-硫化蛋白质的名称,并确定了蛋白质的特定半胱氨酸位点。然而,完全封闭蛋白质样品非常困难,因此很容易产生假阳性结果。
AIMS提供的是高效专业的蛋白过硫化鉴定服务,有专业的HPLC-MS/MS质谱平台,可以分析各种真核生物和原核生物样本。通过探针特异性标记过硫化修饰蛋白,进行定性与定量分析。